Giới thiệu
Trong lĩnh vực hóa học, oxit là một khái niệm quan trọng. Trong bài viết này, chúng ta sẽ tìm hiểu về hai loại oxit quan trọng là Canxi Oxit và Lưu huỳnh đioxit, bao gồm tính chất hóa học, ứng dụng và cách sản xuất.
Canxi Oxit (CaO)
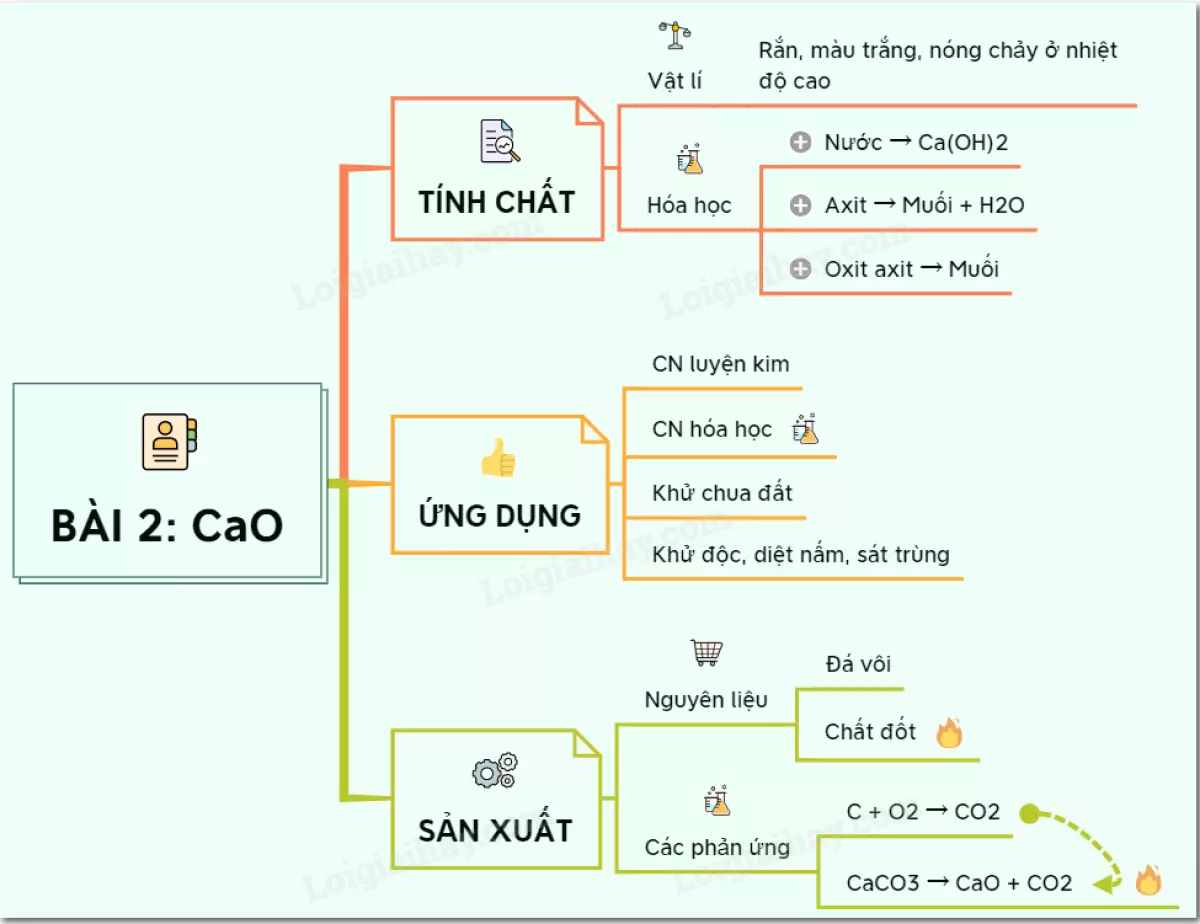
1. Tính chất hóa học
Canxi Oxit, hay còn gọi là vôi sống, là một oxit bazơ tan trong nước và có những tính chất hóa học sau:
a) Tác dụng với nước: Canxi Oxit phản ứng với nước tạo thành Canxi Hydroxit (Ca(OH)₂), còn được gọi là vôi tôi. Nó là một chất rắn màu trắng, ít tan trong nước và có tính bazơ.
Ví dụ: CaO + H₂O → Ca(OH)₂
b) Tác dụng với axit: Canxi Oxit phản ứng với axit tạo thành muối và nước.
Ví dụ: CaO + 2HCl → CaCl₂ + H₂O
c) Tác dụng với oxit axit: Canxi Oxit phản ứng với oxit axit tạo thành muối.
Ví dụ: CaO + CO₂ → CaCO₃
2. Ứng dụng của canxi oxit
Canxi Oxit có nhiều ứng dụng quan trọng như sau:
- Trong công nghiệp luyện kim và công nghiệp hóa học.
- Trong nông nghiệp, Canxi Oxit được sử dụng để khử chua đất trồng trọt, xử lí nước thải công nghiệp và các công việc sát trùng, diệt nấm, khử độc môi trường.
- Do tính hút ẩm mạnh, Canxi Oxit cũng được sử dụng để làm khô nhiều chất.
3. Sản xuất Canxi Oxit trong công nghiệp
Nguyên liệu để sản xuất Canxi Oxit là đá vôi (chứa CaCO₃). Chất đốt có thể sử dụng là than đá, củi, dầu, khí tự nhiên,...
Các phản ứng hóa học xảy ra khi nung vôi bao gồm:
- Than cháy sinh ra khí CO₂ và nhiệt:
C + O₂ → CO₂
- Nhiệt phân đá vôi ở nhiệt độ trên 900°C:
CaCO₃ → CaO + CO₂
 Hình ảnh minh họa về Canxi Oxit
Hình ảnh minh họa về Canxi Oxit
Lưu huỳnh đioxit (SO₂)
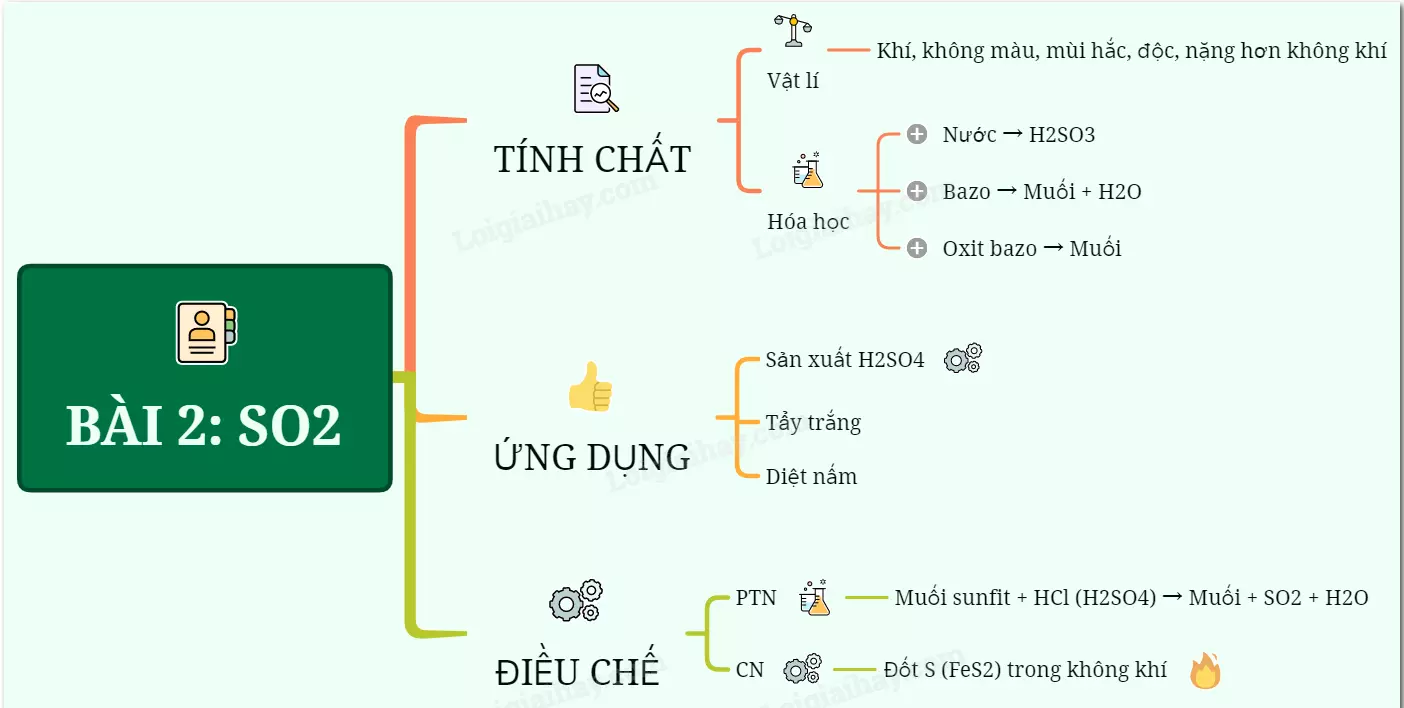
1. Tính chất vật lí
Lưu huỳnh đioxit là chất khí không màu, có mùi hắc, độc (gây ho, viêm đường hô hấp) và có trọng lượng cao hơn không khí.
2. Tính chất hóa học
Lưu huỳnh đioxit là một oxit axit tan trong nước và có những tính chất hóa học sau:
a) Tác dụng với nước tạo thành axit sunfurơ:
SO₂ + H₂O → H₂SO₃ (axit sunfurơ)
Lưu huỳnh đioxit là một chất gây ô nhiễm không khí và có thể gây ra hiện tượng mưa axit.
b) Tác dụng với dung dịch bazơ tạo thành muối và nước:
Ví dụ: SO₂ + Ca(OH)₂ → CaSO₃ + H₂O
Khi SO₂ tác dụng với dung dịch bazơ, có thể tạo muối trung hòa và muối axit.
c) Tác dụng với oxit bazơ tạo thành muối:
Ví dụ: SO₂ + Na₂O → Na₂SO₃
3. Ứng dụng của lưu huỳnh đioxit
Lưu huỳnh đioxit có nhiều ứng dụng quan trọng như sau:
- Phần lớn SO₂ được sử dụng để sản xuất axit sunfuric (H₂SO₄).
- Ngoài ra, lưu huỳnh đioxit còn được dùng làm chất tẩy trắng, chất diệt nấm mốc,...
4. Điều chế lưu huỳnh đioxit
a) Trong phòng thí nghiệm: Sử dụng muối sunfit tác dụng với axit mạnh như HCl, H₂SO₄,...
Ví dụ: Na₂SO₃ + H₂SO₄ → Na₂SO₄ + SO₂ + H₂O
b) Trong công nghiệp: Đốt lưu huỳnh hoặc quặng pirit sắt FeS₂ trong không khí.
S + O₂ → SO₂
4FeS₂ + 11O₂ → 2Fe₂O₃ + 8SO₂
 Hình ảnh minh họa về Lưu huỳnh đioxit
Hình ảnh minh họa về Lưu huỳnh đioxit
Đó là những thông tin cơ bản về Canxi Oxit và Lưu huỳnh đioxit. Hy vọng qua bài viết này, bạn đã hiểu rõ hơn về tính chất, ứng dụng và quy trình sản xuất của hai loại oxit này.

















