Hóa trị: Khái niệm cần hiểu
Hóa trị của một nguyên tố đại diện cho số liên kết hóa học mà một nguyên tử của nguyên tố đó tạo nên trong phân tử. Đối với hợp chất ion, hóa trị được gọi là điện hóa trị và có giá trị bằng với điện tích của ion tạo thành từ nguyên tố đó.
Ví dụ:
- Trong NaCl, Na có điện hóa trị 1+ và Cl có điện hóa trị 1−.
- Trong H2O, H có điện hóa trị 1+ và O có điện hóa trị 2−.
Lưu ý:
- Cách biểu diễn hóa trị của một nguyên tố là ghi giá trị điện tích trước, sau đó là dấu của điện tích.
- Các nguyên tố kim loại trong nhóm IA, IIA, IIIA có thể nhường số electron ở lớp ngoài cùng và có hóa trị lần lượt là 1+, 2+, 3+...
- Các nguyên tố phi kim trong nhóm VIA, VIIA có 6, 7 electron ở lớp ngoài cùng và có thể nhận thêm 2 hoặc 1 electron để đạt đủ 8 electron, vì vậy hóa trị của chúng là 2−, 1−...
Bảng hóa trị của các nguyên tố phổ biến trong hóa học
Dưới đây là danh sách các nguyên tố phổ biến khi làm bài tập hóa học, hãy ghi nhớ bảng này để dễ dàng hoàn thành bài tập.
| Số proton | Tên Nguyên tố | Ký hiệu hoá học | Kim loại/Phi kim | Nguyên tử khối | Hoá trị |
|---|---|---|---|---|---|
| 1 | Hiđro | H | Phi kim | 1 | 1 |
| 2 | Heli | He | Phi kim | 4 | 3, 4 |
| 3 | Liti | Li | Kim loại | 7 | 1 |
| 4 | Beri | Be | Kim loại | 9 | 2 |
| 5 | Boron | B | Phi kim | 11 | 3 |
| 6 | Cacbon | C | Phi kim | 12 | 2, 4 |
| 7 | Nitơ | N | Phi kim | 14 | 3, 5 |
| 8 | Oxi | O | Phi kim | 16 | 2 |
| 9 | Flo | F | Phi kim | 19 | 1 |
| 10 | Neon | Ne | Phi kim | 20 | 0 |
| 11 | Natri | Na | Kim loại | 23 | 1 |
| 12 | Magi | Mg | Kim loại | 24 | 2 |
| 13 | Nhôm | Al | Kim loại | 27 | 3 |
| 14 | Silic | Si | Phi kim | 28 | 4 |
| 15 | Photpho | P | Phi kim | 31 | 3, 5 |
| 16 | Lưu huỳnh | S | Phi kim | 32 | 2, 4, 6 |
| 17 | Clo | Cl | Phi kim | 35,5 | 1 |
| 18 | Argon | Ar | Phi kim | 39,9 | 0 |
| 19 | Kali | K | Kim loại | 39 | 1 |
| 20 | Canxi | Ca | Kim loại | 40 | 2 |
... | 24 | Crom | Cr | Kim loại | 52 | 2, 3 | | 25 | Mangan | Mn | Kim loại | 55 | 2, 4, 7 | | 26 | Sắt | Fe | Kim loại | 56 | 2, 3 | | 29 | Đồng | Cu | Kim loại | 64 | 1, 2 | | 30 | Kẽm | Zn | Kim loại | 65 | 2 | | 35 | Brom | Br | Phi kim | 80 | 1 | | 47 | Bạc | Ag | Kim loại | 108 | 1 | | 56 | Bari | Ba | Kim loại | 137 | 2 | | 80 | Thuỷ ngân | Hg | Kim loại | 201 | 1, 2 | | 82 | Chì | Pb | Kim loại | 207 | 2, 4 |
Ghi chú:
- Khi liên kết nguyên tử Hiđro với kim loại, nguyên tố phi kim luôn có hóa trị đầu tiên trong bảng.
- Một số kim loại phổ biến như sắt, đồng, mangan có nhiều hóa trị.
- Một số phi kim phổ biến như cacbon, nitơ, lưu huỳnh cũng có nhiều hóa trị.
Bảng hóa trị của gốc axit và bazơ thường gặp
Dưới đây là danh sách hóa trị của một số gốc axit và bazơ:
| Tên nhóm | Hoá trị | Gốc axit | Axit tương ứng | Tính axit |
|---|---|---|---|---|
| Hiđroxit(*) | (OH) | Nitrat (NO3) | INO3 | HNO3 |
| Sunfat (SO4) | Cacbonat (CO3) | IISO4 | H2SO4 | Mạnh |
| Photphat (PO4) | (PO4) | Cl | HCl | Mạnh |
| PO4 | H3PO4 | Trung bình | ||
| CO3 | H2CO3 | Rất yếu (không tồn tại) |
Ghi chú:
- Trong bảng hóa trị lớp 8, hóa trị của nhóm -OH là 1.
- Hóa trị của nhóm -NO3 là 1.
- Hóa trị của nhóm =SO4 là 2.
- Hóa trị của nhóm =CO3 là 2.
- Hóa trị của nhóm PO4 là 1, 2, 3. Khi kết hợp với kim loại, nhóm này có thể tạo ra hai loại muối axit và một loại muối trung hòa, cả ba đều chứa gốc PO4.
Nguồn tham khảo hóa trị các nguyên tố hoá học
Bạn có thể tìm hiểu về hóa trị của các nguyên tố hoá học theo các nguồn sau:
- Tra cứu tại bảng tuần hoàn các nguyên tố hoá học.
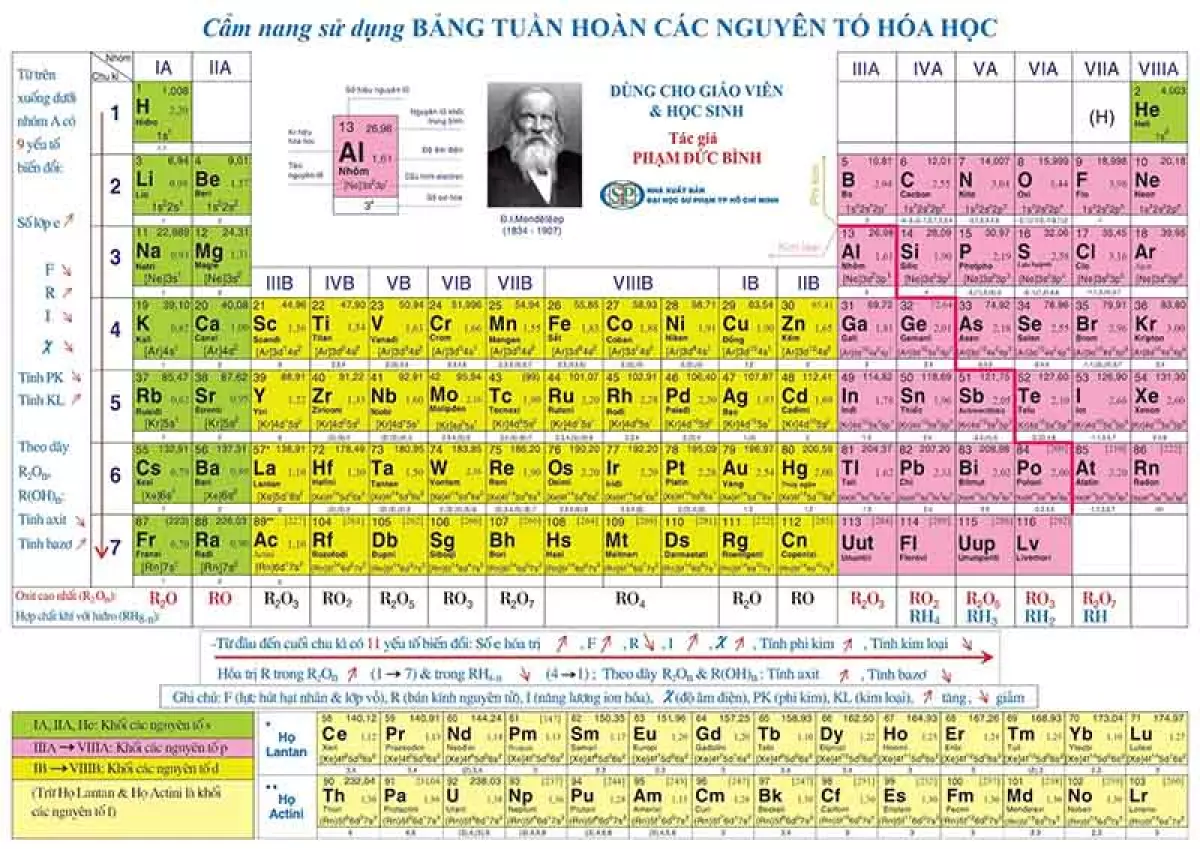 Xem bảng tuần hoàn hoá học
Xem bảng tuần hoàn hoá học
- Tra cứu trong sách giáo khoa hóa học lớp 8 và lớp 10.
- Sử dụng công cụ tìm kiếm như Chrome, Cốc Cốc...
- Truy cập vào mục bảng hóa trị trên website ihoc.vn.
 Xem bảng hoá trị trên website Ihoc.vn
Xem bảng hoá trị trên website Ihoc.vn
Nhớ hóa trị với bài ca hóa trị
Bài ca hóa trị số 1
 Bài ca hoá trị hoá học lớp 8
Bài ca hoá trị hoá học lớp 8
Bài ca hóa trị số 2
 Bài ca hoá trị nâng cao
Bài ca hoá trị nâng cao
Chúng tôi hy vọng qua bài viết này, bạn đã hiểu sâu hơn về bảng hóa trị. Hãy ghi nhớ và nắm vững kiến thức này bằng cách học thuộc và làm thật nhiều bài tập để đạt kết quả học tập tốt nhất.

















